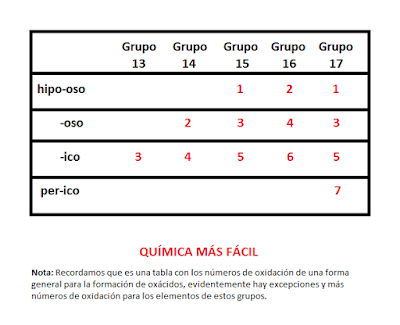
Para saber formular este tipo de compuestos debemos conocer a la perfección los estados de oxidación de los elementos, y para ello os dejamos una pequeña tabla con los principales estados de oxidación de forma general para los no metales.
Los oxácidos se obtienen por reacción de óxidos con agua y de esta forma obtenemos el compuesto ternario del que se habló en el post anterior. La adición de moléculas de agua puede variar.
La adición de una molécula de agua recibe el prefijo META-
(menor contenido de agua)
La adición de dos moléculas de agua recibe el prefijo DI- o PIRO-
( el número del elemento central es el doble a lo esperado)
La adición de tres moléculas de agua recibe el prefijo ORTO-
(mayor contenido de agua)
Existen gran cantidad de peculiaridades en la formulación de oxácidos, pero nos centraremos en los necesarios para superar la prueba de acceso a la universidad, por ello consideraremos como ácidos especiales (B, Si, P, As, Sb y V).
¿Porqué consideramos especiales a estos ácidos? Porque son oxácidos formados con mayor contenido en agua que el resto, y por tanto aunque le corresponderían el prefijo ORTO-, éste se obvia (NO SE PONE!!), ya que todos conocemos su peculiaridad. Sin embargo, cuando la adición de agua es de una (META-) o dos (Di-) moléculas de agua, entonces sí que hay que añadir el prefijo, ya que no es la hidratación usual para estos elementos.
El Silicio alcanza su máxima hidratación (ORTO-) con dos moléculas de agua, y de ahí la diferencia con los anteriores.
 |
Hablemos un poco del cromo, es un metal y forma unos oxácidos que alguno de ellos puede causar confusión. El cromo cuando forma oxácidos actuará con el número de oxidación (6+) obteniéndose:
El manganeso, otro metal muy característico con una variación de colores espléndidos. Pues bien, este elemento tiene una gran cantidad de números de oxidación, aunque lo usual es que para la formulación de oxácidos utilice (6+) y (7+) y en contadas ocasiones veréis (4+):
Os dejo una foto con los distintos colores del manganeso.





Existe el Mn+1? En el acetato de manganeso, usado como catalizador por su propiedad de formar radicales libres?
ResponderEliminarHola Anónimo!! En el acetato de manganeso nuestro querido manganeso actúa con (2+), Mn(CH3COO)2
EliminarUn saludoo!
Hola, disculpe hay solidos de Mn color verde?, tengo un polvo que quise sintetizar como con mn4+, pero no me da los espectros característicos de este, y el polvo es verde, igulamente sintetize exactamente igual la misma estructura cristalina y es incolora como casi cualquier semiconductor con band gap arriba de 4 ev.
ResponderEliminar